一、您如何看待帕米帕利用于中国携带gBRCAm晚期或转移性HER2阴性乳腺癌BGB-290-201这一临床研究?
BRCA1/2基因是目前已知最主要的乳腺癌易感基因,BRCA1/2基因突变会导致乳腺癌患病风险增加,而且携带BRCA1/2基因突变的乳腺癌在临床上表现出更强的侵袭性,是一种预后相对较差的乳腺癌类型,临床上有巨大未被满足的需求。在中国基于CBCSG006和GAP研究均奠定了铂类在三阴性乳腺癌(TNBC)一线应用的基石地位,含铂化疗成为中国晚期TNBC一线首选的方案,中国目前尚无靶向治疗药物批准用于gBRCAm乳腺癌的治疗。
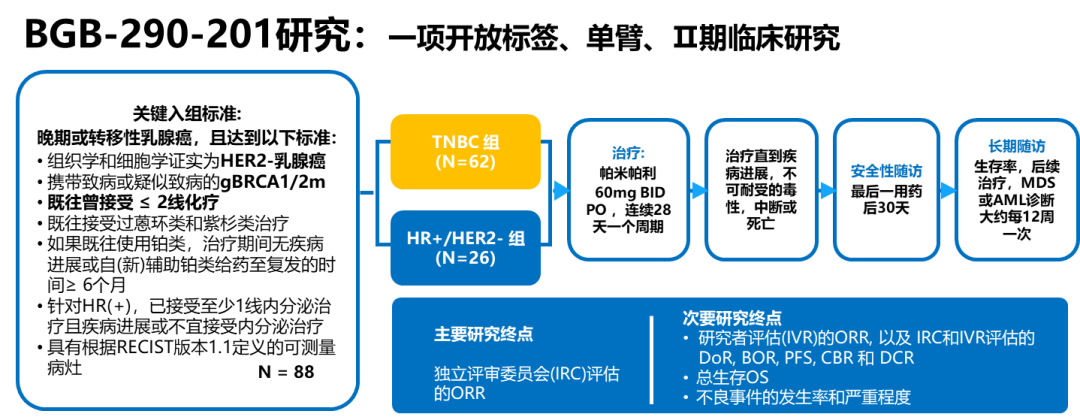
帕米帕利BGB-290-201研究是一项开放标签、单臂、II期研究,在中国25家中心开展,旨在探索帕米帕利用于携带gBRCAm晚期或转移性TNBC和HR+/HER2-乳腺癌患者的疗效和安全性,是迄今为止首个PARP抑制剂专门针对中国gBRCAm乳腺癌开展的临床研究1。国外虽然有PARP抑制剂获批用于晚期HER2阴性gBRCAm乳腺癌治疗,但这些国际多中心III期研究仅纳入少量中国患者,比如OlympiAD研究在中国大陆仅入组32例患者,而EMBRCACA研究未在中国开展。BGB-290-201研究在国内入组BRCA突变患者达到88例,此次是迄今为止PARP抑制剂在中国晚期gBRCAm乳腺癌中进行的最大样本量临床研究数据发布1,3,对我们了解PARP抑制剂在中国乳腺癌治疗有很好的指导借鉴意义。
BRCA1/2基因筛查是临床试验中面临的一大问题,也是PARP抑制剂在实际临床应用中专家最关心的问题之一。乳腺癌患者gBRCAm基因突变率约为5-10%,要挑选出携带基因突变的患者,不仅需要专家的临床经验,也需要检测技术方法的成熟。在BGB-290-201研究入组过程中,我们中心共筛选64例患者,其中gBRCAm患者14例,最后成功入组10例,筛选成功率达到21.9%,远高于gBRCAm在乳腺癌患者中的发生率。主要依据患者分子分型(如TNBC)、肿瘤家族史,以及患者发病年龄偏小等因素,提高筛选成功率。当然基因检测技术的进步也是重要原因,当时2015年OlympiAD研究开展时,我们中心共筛选30例患者,仅3例患者携带gBRCAm,最终成功入组2例,约10%的筛选成功率,通过这个例子也可以看出无论国内专家筛选gBRCAm患者的经验,还是国内基因检测技术平台的成熟度都有了明显的提高。
二、帕米帕利用于中国携带gBRCAm晚期HER2阴性乳腺癌BGB-290-201研究疗效数据如何?
帕米帕利用于中国88例晚期gBRCAm乳腺癌患者的疗效数据,总体上与同类药物具有可比性。入组的62例TNBC和26例HR+/HER2-患者中,帕米帕利用于TNBC组中位持续缓解时间(DoR)达到7.0个月,HR+/HER2-组数据帕米帕利的中位DoR为7.5个月,这可能与帕米帕利不是药物外排泵(P糖蛋白)底物,具有一定延缓耐药发生的作用相关。
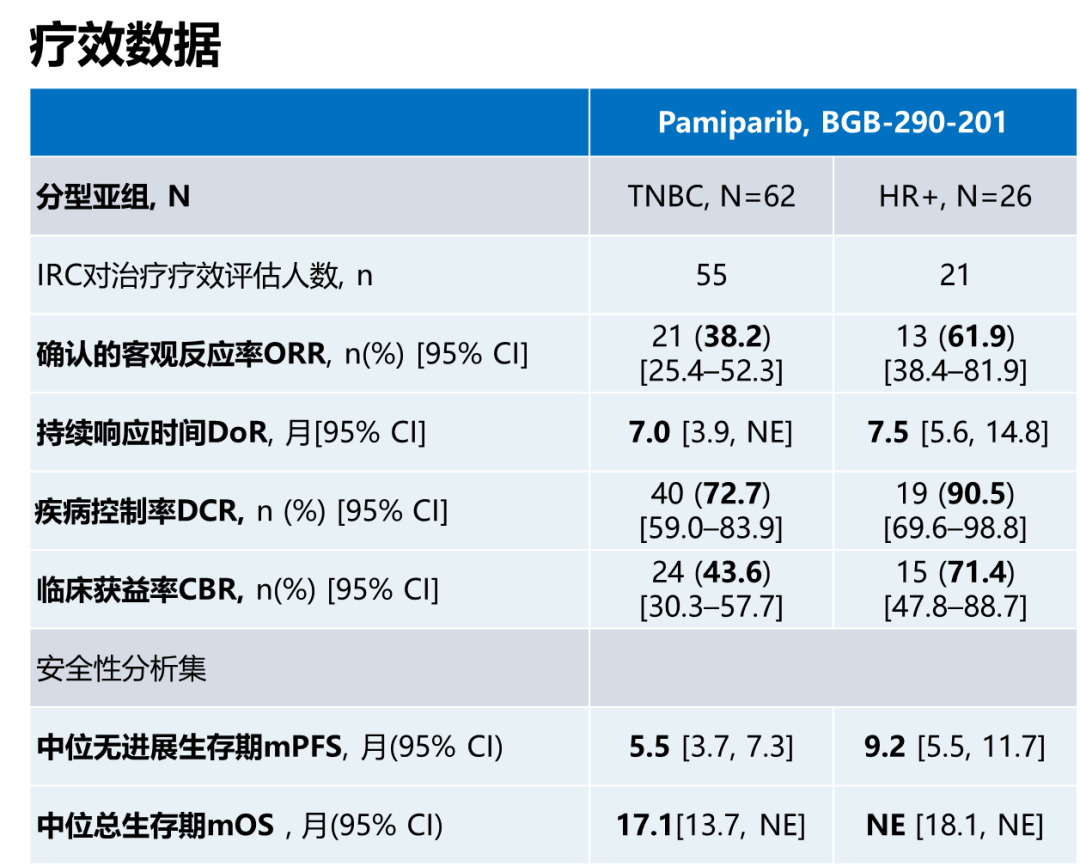
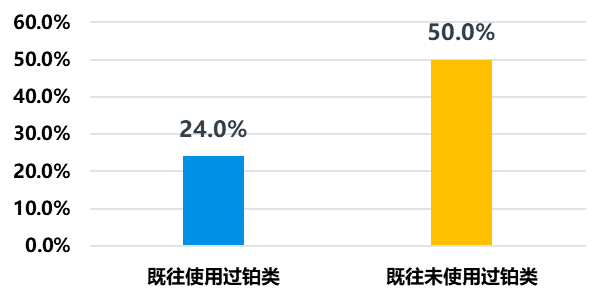
从确认的客观反应率(ORR)来看,帕米帕利在HR+/HER2-组数据ORR=61.9%,但TNBC组ORR数据为38.2%,仔细分析发现帕米帕利应用于TNBC一线中ORR高达66.7%,二线34.5%,提示在TNBC一线应用有更高的响应率;而且既往经过铂治疗的患者使用PARP抑制剂会降低ORR,未经铂治疗患者的ORR高达50%,而铂治疗后患者的ORR仅有24%。

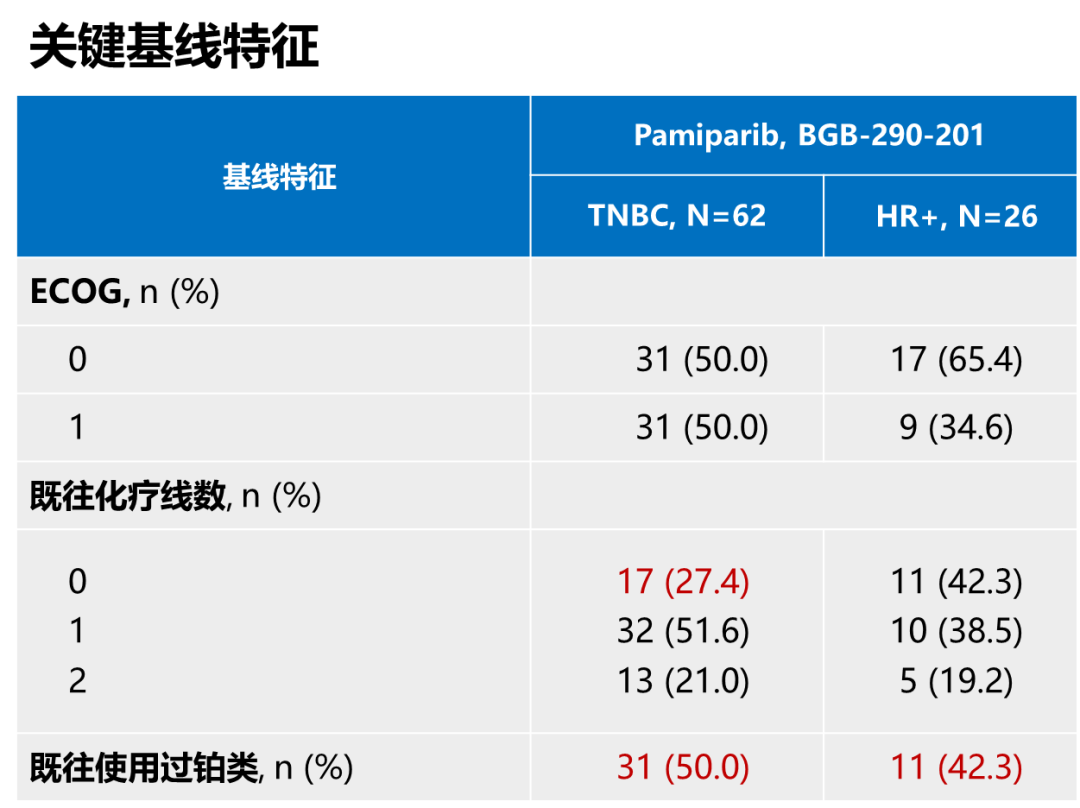
疗效数据需要结合入组基线特征比较分析才能发现产生差异的原因。BGB-290-201研究与同类研究相比,TNBC组纳入较少的未接受过化疗患者(仅为27.4%),而且有更高的既往使用过铂类比例(TNBC组为50%,HR+/HER2-组为42.3%),中国专家更接受铂类在晚期TNBC一线应用,而国外专家更多将铂类应用在(新)辅助阶段,因此国外研究人群有更长的无铂间隔。BGB-290-201研究入组人群中应用过铂类比例相对较高,无铂间隔相对较短,这可能是帕米帕利在TNBC组ORR数据略低的主要原因。
值得欣喜的是,虽然TNBC组取得的ORR略低,但是TNBC组达到的中位无进展生存期(PFS)达到5.5个月 ,中位总生存期(OS)也达到17.1个月;同时在HR+/HER2-组的中位PFS达到9.2个月,中位OS还尚未达到,相较于临床化疗单药数据有明显延长,与同类PARP抑制剂研究数据相当。
三、既然含铂方案是中国晚期TNBC一线常用的治疗选择,那PARP抑制剂该如何与铂类药物排兵布阵来达到更佳的治疗获益?
这是一个很好的问题,临床医生一方面不愿意轻易放弃铂类在晚期TNBC的治疗,一方面又希望通过PARP抑制剂来提高晚期TNBC患者的生存。对于TNBC患者如何对PARP抑制剂和铂类的排兵布阵是一个很有挑战的问题,是在铂类后再使用PARP抑制剂,还是先使用PARP 抑制剂再考虑铂类,甚至是否可以进行PARP抑制剂与铂类的联合?
目前PARP抑制剂与铂类搭配组合在乳腺癌领域数据还比较少,仅有的数据主要出自PARP抑制剂中捕获(Trapping)能力最弱的Veliparib,因为捕获能力比较弱,Veliparib进行了一系列与铂类联合使用的探索。晚期乳腺癌的探索主要有两个研究:一是晚期HER2阴性乳腺癌联合卡铂的BROCADE3研究,另一个是晚期TNBC联合顺铂的SWOG1416研究。
在BROCADE3研究中,对晚期HER2阴性gBRCAm乳腺癌中通过Veliparib 联合卡铂和紫杉醇,中位PFS达到14.5个月,比对照组(12.6个月)高出1.9个月,HR=0.705,P=0.002,达到统计学差异,降低约30%的疾病进展风险。但在解释BROCADE3研究到后期才分离的PFS曲线也须谨慎,有两个关键原因:首先,相当大比例停止联合化疗且无疾病进展的患者仍在继续接受Veliparib单药治疗,可能是Veliparib单药治疗驱动PFS曲线分离;其次,2年或3年PFS率并非乳腺癌OS获益的替代终点。通过对BROCADE3研究的基线特征分析,其中纳入更多作为一线治疗的患者,以及较少既往接受过铂类药物的患者,因此这一联合治疗方案的PFS虽然能达到14.5个月,但与其他PARP抑制剂的单药疗效比较时,需要将其基线特征以及方案本身的差异考虑在内。

而在SWOG1416研究,在TNBC的gBRCAm中Veliparib 联合顺铂没有发现PFS和OS获益,而是在BRCA样乳腺癌(即HRD评分≥42分、体系BRCA1/2突变,BRCA1甲基化和除BRCA1/2之外的其他胚系同源重组修复[HRR]基因突变)中观察到PFS获益,5.9m vs 4.2m,HR=0.53, p=0.006,达到统计学差异,OS有延长的趋势。
但是这两个试验数据都是基于Veliparib研究,考虑到捕获能力及安全性因素,其他PARP抑制剂联合铂类鲜有此类研究,疗效及安全性尚未可知;BROCADE3研究中,对无疾病进展患者继续使用Veliparib治疗有点类似在做PARP抑制剂单药维持治疗,其实,PARP抑制剂在卵巢癌铂敏感维持治疗数据已经非常成熟,而且相应适应症也已经获批,这是否可以提示在乳腺癌领域也可以采取铂敏感后使用PARP抑制剂维持的治疗方式?对于PARP抑制剂和铂类排兵布阵问题,目前数据还是太少,期待未来有更多严谨设计的临床试验数据支持。
四、您对PARP抑制剂在乳腺领域应用有哪些期待和展望?
看到PARP抑制剂现有公布的数据,给临床专家的治疗带来很多思考,其实也可以说更多的是期待。如何筛选更具有针对性的治疗人群、PARP抑制剂最佳应用时机、与其他种类药物的联合应用策略,以及如何预测对PARP抑制剂耐药等问题一直是临床医生和研究者所面临的挑战和困惑。
展望一、PARP抑制剂不局限于gBRCAm人群,还应参考HRR或HRD等生物标志物
PARP抑制剂在Beyond BRCA人群进行了一系列研究探索,并取得突破。Talazoparib在TBB研究中发现其在HRR人群治疗ORR达到31%;另外,在TBCRC 048研究中,Olaparib单药用于携带胚系或体系HRR基因突变的晚期乳腺癌,在胚系和体系的两个cohort中都达到主要研究终点,而且在携带体系BRCA基因突变的患者中达到50%,胚系PALB2基因突变的患者中ORR达到82%,接近甚至超过胚系BRCA基因突变人群的ORR数据;同时,Veliparib的BrighTNess研究及Olaparib的GeparOla研究均发现,PARP抑制剂应用于HRD人群有病理完全缓解(pCR)的获益趋势。
虽然铂类在中国晚期TNBC一线治疗中占据重要地位,新兴的免疫检查点抑制剂(PD-[L]1类药物)给PD-L1+ TNBC也带来PFS/OS获益,但PARP抑制剂单药对一线gBRCAm患者带来的获益也非常明显。基于这三类药物都为晚期TNBC患者一线治疗带来生存获益,在做临床治疗决策时,一方面我们需要依据患者肿瘤biomarker(如PD-L1表达、BRCA/HRR/HRD状态)进行分类治疗,另一方面也可以考虑在患者铂类不耐受或免疫器官功能不合适的情况下,优先选择使用PARP抑制剂。而在TNBC二线及以后的治疗中,通常患者免疫状态较差,现有数据很难支持免疫治疗在后线使用,PARP抑制剂因其强效、低毒性、使用方便等特点可能会是一个优选的治疗选择。
同样,在HR+/HER2-晚期乳腺癌,CDK4/6抑制剂在近些年研究中给患者带来明显PFS/OS获益,然而这些患者也依然会面临耐药的问题,PARP抑制剂会是内分泌耐药患者一个不错的治疗选择,这当然也需要结合BRCA/HRR/HRD等biomarker结果一起考虑。
除了上面提到与铂类化疗药物的联合,PARP抑制剂另一个重要的拓展方向就是与免疫治疗的联合,已经有相关报道PARP抑制剂可以增加PD-1的疗效,机制上可能是增加PD-L1表达等。且多种实体瘤表明PARP抑制剂和PD-(L)1类药物间可以联合,且具有好的安全性。
首先MEDIOLA研究,在gBRCAm的HER2阴性晚期乳腺癌中,PARP抑制剂联合PD-L1单抗治疗的初期结果非常令人鼓舞,ORR在1-2线患者达到70%,在3线及以后患者也达到50%,PFS在1-2线患者达到11.7个月(95%CI:4.6-13.8),OS在1-2线患者也达到23.4个月(95%CI: 16.3,NC)。其次,正在开展的DORA研究是探索PARP抑制剂联合PD-L1单抗在铂类敏感晚期三阴乳癌维持治疗中的疗效,该研究是PARP抑制剂正式向乳腺癌的维持治疗推进。帕米帕利与免疫治疗联合也有一些初步探索,初期数据发表在《Lancet Oncology》。以下是PARP抑制剂联合免疫治疗正在开展的一系列研究,期待乳癌领域PARP抑制剂与免疫治疗的火花能够更多地迸发。

此外,有必要对现有研究数据进一步随访和分析,揭示PARP抑制剂的潜在耐药机制以及PARP抑制剂与铂类药物之间的交叉耐药等问题,提早关注患者用药情况,从而更好地做好患者的长期管理。
最后,今年OlympiA大型III期研究让PARP抑制剂挺进早期乳腺癌辅助治疗,PARP抑制剂在乳腺癌领域的数据及应用也日渐成熟,期待PARP抑制剂给乳腺癌患者带来更多希望。
中国临床肿瘤学会(CSCO)肿瘤心脏病学专家委员会副主任委员中国研究型医院精准医学与肿瘤MDT专业委员会副主任委员
?





 京公网安备 11010502033352号
京公网安备 11010502033352号