乳腺癌是威胁我国女性健康的“第一大恶性肿瘤”。据2019年国家癌症中心发布的最新全国癌症统计数据显示,全国乳腺癌新发病例占女性恶性肿瘤发病的17.10%,位居女性恶性肿瘤发病首位,每年发病人数约为30.4万[1]。
“山重水复疑无路,柳暗花明又一村”。罹患乳腺癌,让众多患者一度踏入生死边缘;所幸,乳腺癌预后相对良好,无疑又给了患者重生的希望。据全球癌症生存趋势监测报告CONCORD-3显示,2010-2014年我国乳腺癌患者的5年生存率为83.2%[2]。
目前,越来越多的乳腺癌患者可获得长期生存,乳腺癌正逐渐成为可以控制的“慢性病”。那么,获得长期生存的乳腺癌患者会再复发吗?如何更好地降低复发风险?乳腺癌辅助内分泌治疗的里程碑式研究——ATAC试验的10年结果为之揭晓答案。
ATAC是一项在全球21个国家381个医学中心开展的双盲、随机、大规模的早期乳腺癌辅助治疗试验,共纳入了9366例可进行手术治疗的绝经后浸润性乳腺癌患者,评估比较他莫昔芬单药与阿那曲唑单药、以及二者联合治疗5年的疗效和安全性。
主要终点为无病生存(DFS)。次要终点为至复发时间(TTR)、至远处复发时间(TTDR)、新发对侧乳腺癌(CLBC)发生率、总生存和死亡。
初步分析结果(中位随访33个月和47个月)显示,阿那曲唑组与他莫昔芬组相比,显著延长DFS和TTR,并降低CLBC发生率。但是,联合用药组与他莫昔芬组相比没有疗效或安全性优势,因此研究关闭了联合用药组。

图1:2010年,ATAC试验10年结果发表于《The Lancet Oncology》杂志
早在1996年,Thomas Saphner等的研究[3]显示,激素受体阳性乳腺癌有2个复发高峰,即术后2~3年的早期复发高峰和术后8~10年远期复发高峰。
ATAC试验10年结果[4]显示,阿那曲唑初始辅助治疗显著降低术后近期和远期两大复发高峰(图2B)。在激素受体阳性患者中,与他莫昔芬组相比,阿那曲唑组的术后近期复发风险降低32%(0~2年HR 0.68),5年治疗结束后,阿那曲唑仍能降低约20%的术后远期复发风险(>5年HR 0.81,10年HR 0.79,表1)。
表1 在总人群和激素受体阳性患者中不同随访时间的疗效终点
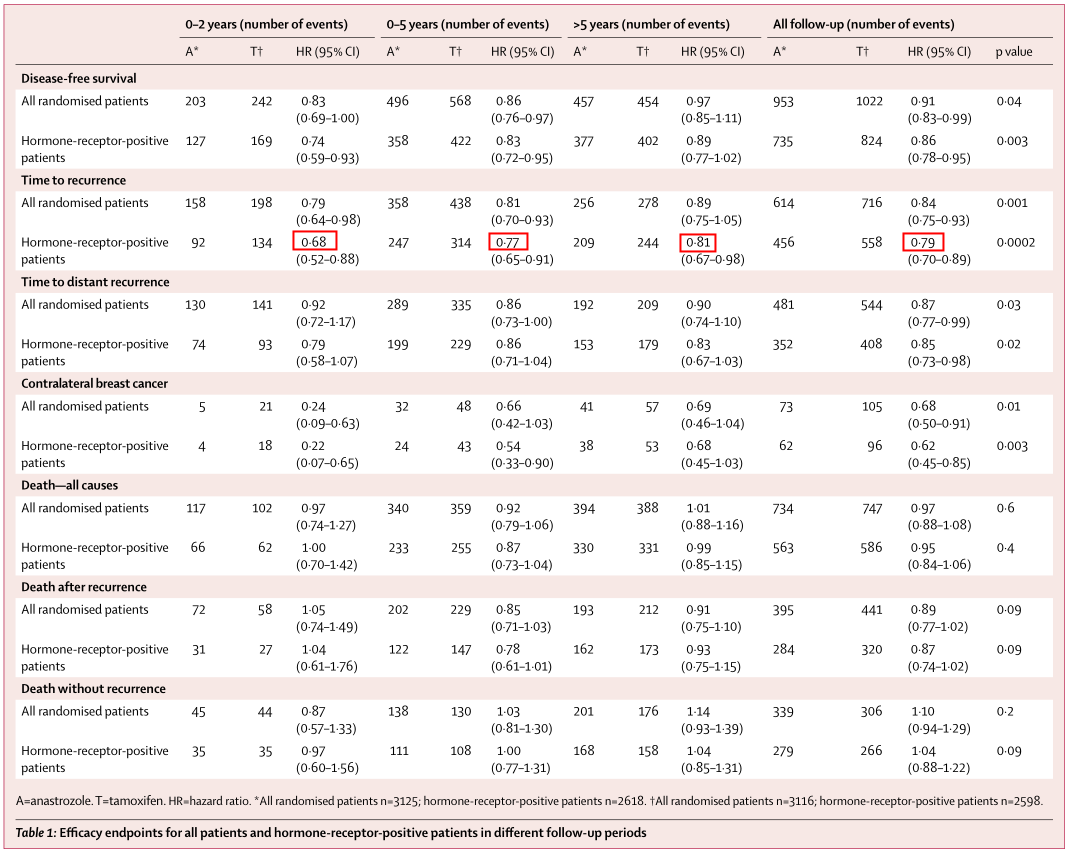

图2 激素受体阳性患者的至复发时间曲线(A)Kaplan-Meier复发率曲线(B)风险比曲线
同时,在激素受体阳性患者中,与他莫昔芬治疗相比,阿那曲唑治疗降低4大事件风险:
-
与他莫昔芬组相比,阿那曲唑组的DFS显著改善,事件(复发、死亡或新发乳腺癌)发生风险降低14%(HR 0.86,P=0.003),并体现出延续效应(5年事件发生率:16.5% vs 13.9%,绝对差异为2.6%;10年件发生率:33.7% vs 30.2%,绝对差异为3.5%)[5]。
-
与他莫昔芬组相比,阿那曲唑组TTR明显延长,复发风险降低21%(HR 0.79,P=0.0002),复发率的绝对差异随时间延长而增大(5年时阿那曲唑组绝对获益为2.7%,10年时则为4.3%,图1A)。
-
与他莫昔芬组相比,阿那曲唑组的TTDR明显改善,远处复发风险降低15%(HR 0.85,P=0.02),并体现出延续效应(5年远处复发率:9.2% vs 7.9%,绝对差异为1.3%;10年远处复发率:17.7% vs 15.1%,绝对差异为2.6%;图2)。
-
与他莫昔芬组相比,阿那曲唑组的CLBC发生率明显更低,CLBC事件风险降低38%(HR 0.62,P=0.003), 并体现出延续效应(5年CLBC发生率:1.8% vs 1.0%,绝对差异为0.8%;10年CLBC发生率:4.9% vs 3.2%,绝对差异为1.7%;图3)。

图2 激素受体阳性患者的至远处复发时间Kaplan-Meier曲线
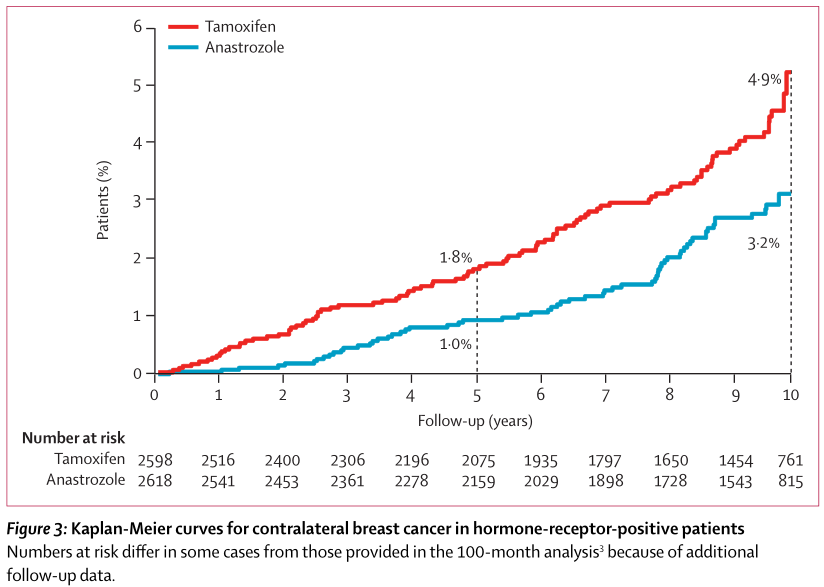
图3 激素受体阳性患者的对侧乳腺癌事件Kaplan-Meier曲线
在关于AI辅助内分泌治疗乳腺癌的研究中,BIG 1-98、TEAM和ATAC研究均证实,5年AI初始治疗能够改善绝经后激素受体阳性早期乳腺癌患者的DFS。
BIG 1-98试验在绝经后激素受体阳性早期乳腺癌患者中,比较他莫昔芬和来曲唑单药或序贯治疗的疗效。中位随访12.6年更新数据显示,来曲唑组与他莫昔芬组相比,DFS事件风险降低9%,0~5年和5~10年的CLBC发生风险分别降低38%和53%,而10年后CLBC发生风险未能继续与前10年保持一致(HR 1.35),即10年后来曲唑降低CLBC的效果不如他莫昔芬[6]。未报告TTR数据。
TEAM试验在绝经后早期乳腺癌患者中,评估依西美坦单药与他莫昔芬序贯依西美坦辅助治疗的疗效。10年随访结果显示,两治疗组的DFS无明显差异[7]。未报告CLBC数据。
此外,MA.27研究和FACE研究均没有达到主要终点,未能证明依西美坦和来曲唑辅助治疗疗效优于阿那曲唑。
基于以上研究数据说明,阿那曲唑是拥有最完整初始治疗疗效数据、拥有10年中位随访时间、被证实显著持久降低CLBC事件风险的AI。
“饮水思源”,在乳腺癌内分泌治疗百余年的发展史上,有3大里程碑事件推动着乳腺癌治疗进步和发展。
19世纪末,英国外科医生George Thomas Beatson首次报道,切除双侧卵巢可治疗局部晚期乳腺癌,文章发表在《柳叶刀》杂志上并引起了业界的极大轰动,由此开创了乳腺癌内分泌治疗的先河,树立了乳腺癌内分泌治疗的第一个里程碑。
20世纪70年代,最初被作为避孕药研发成功的他莫昔芬,获批用于治疗绝经后晚期乳腺癌和早期乳腺癌辅助内分泌治疗,并成为了乳腺癌内分泌治疗的“金标准”,树立了乳腺癌内分泌治疗的第二个里程碑。
20世纪90年代,第三代AI阿那曲唑、来曲唑和依西美坦先后问世。一系列临床试验证实,AI疗效优于他莫昔芬,确立了AI在乳腺癌内分泌治疗中的地位,动摇了他莫昔芬“独领风骚20年”的地位。自此,乳腺癌内分泌治疗开启了新的治疗时代,树立了又一个里程碑。
此外,AI治疗已被写入国内外乳腺癌诊疗指南,开启了乳腺癌内分泌治疗临床实践的新篇章。中国临床肿瘤学会(CSCO)乳腺癌诊疗指南推荐,AI用于绝经后乳腺癌患者的初始辅助治疗(IA级推荐)。这意味着,AI是我国绝经后乳腺癌患者临床治疗的首选辅助内分泌治疗策略。
小结
在乳腺癌内分泌治疗长河中,第三代AI尤其是阿那曲唑,宛如一颗璀璨星星,集多般功效于一身——降低乳腺癌两大复发高峰和四大事件风险,且具有延续效应,为众多乳腺癌患者照亮了生命之路。相信,乳腺癌从“绝症”变成“慢性病”未来可期。
参考文献
[1]郑荣寿,孙可欣,张思维,等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志. 2019;41(1):19-28.
[2]Allemani C, Matsuda T, Di Carlo V, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37?513?025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet. 2018 Mar 17;391(10125):1023-1075.
[3]Saphner T, Tormey DC, Gray R. Annual hazard rates of recurrence for breast cancer after primary therapy[J]. J Clin Oncol. 1996 Oct;14(10):2738-46.
[4]Cuzick J, Sestak I, Baum M, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 10-year analysis of the ATAC trial[J]. Lancet Oncol. 2010;11(12):1135-41.
[5]Cuzick J.Presented at 12th Milan Breast Cancer Conference June,2010.
[6]Ruhstaller T, Giobbie-Hurder A, Colleoni M, et al.Adjuvant Letrozole and Tamoxifen Alone or Sequentially for Postmenopausal Women With Hormone Receptor-Positive Breast Cancer: Long-Term Follow-Up of the BIG 1-98 Trial[J]. J Clin Oncol. 2019 Jan 10;37(2):105-114.
[7]Derks MGM, Blok EJ, Seynaeve C, et al. Adjuvant tamoxifen and exemestane in women with postmenopausal early breast cancer (TEAM): 10-year follow-up of a multicentre, open-label, randomised, phase 3 trial[J]. Lancet Oncol. 2017 Sep;18(9):1211-1220.
审批编号 CN-48050





 京公网安备 11010502033352号
京公网安备 11010502033352号