目前,尚无某种生物标志物可精准指导肿瘤诊断、判断预后和预测肿瘤复发,且单一的生物标志物很难检测某种特定器官的肿瘤。既往多项研究表明cfDNA在实体肿瘤中具有预后价值,作为一种预测肿瘤患者预后的潜在方法,它能否满足临床医生的需求?今年的ESMO大会上传来两项临床研究的最新消息,研究者们均应用液体活检技术,对乳腺癌患者的cfDNA进行深入分析,其研究结果为cfDNA在乳腺癌临床中的应用提供新的理论依据,同时也激起人们新的思考:作为一种无创、简单的新技术,cfDNA能否脱颖而出,成为乳腺癌患者理想的生物靶向标志物?
理论基础
肿瘤在形成和生长过程中,可主动或在凋亡、坏死后释放各种成分到血液中,包括细胞游离DNA(cfDNA,cell-free DNA)、循环肿瘤DNA(ctDNA,circulating tumor DNA)、微小RNA (MiRNAs)、非编码RNA和微囊(如外泌体),它们以单个细胞的形式进行扩散,即循环肿瘤细胞(CTCs,circulating tumor cells),1液体活检可以分析肿瘤细胞释放到血液循环中的各种成分。其中,cfDNA是指存在于血液中的细胞外DNA,健康人的cfDNA主要源于凋亡细胞,而肿瘤患者的cfDNA除了来源于正常细胞,还源于肿瘤细胞的凋亡和坏死,这两种机制同时促进肿瘤患者产生cfDNA(图1)。肿瘤患者的cfDNA中,由肿瘤细胞衍生的部分称为ctDNA,作为cfDNA的一个亚群,它只占血浆cfDNA总量的一小部分,其比例在不同情况下可能会发生改变。而CTCs是指主动进入血管内或被动脱离原发灶或转移灶的肿瘤细胞,这些细胞可能在肿瘤微转移及其形成、生长过程中的任何时间释放,甚至在癌前病变过程中也可能释放。
 图1:肿瘤患者血液中循环cfDNA的来源及其潜在的生物学意义
图1:肿瘤患者血液中循环cfDNA的来源及其潜在的生物学意义
肿瘤患者血液中释放的各种遗传物质及细胞成分作用不同,cfDNA在肿瘤患者体内浓度更高且存在更多突变,在各种实体肿瘤中具有判断预后价值;ctDNA可以被测序,用于肿瘤的基因图谱,加强个体化治疗和纵向筛查;根治性肿瘤切除术后的血浆CTC计数分析有助于早期发现微小残留病灶,协助判断恶性肿瘤的分期和预后。cfDNA在血液中的浓度较高,在液体活检中优于CTC与ctDNA,其作为预测肿瘤患者生存的潜在方法,是目前肿瘤领域的研究热点。
众多研究报道cfDNA在各种实体肿瘤中具有一定的预后预测价值,包括肺癌、胰腺癌、前列腺癌、肝细胞癌、肾细胞癌、结直肠癌和乳腺癌。cfDNA水平与乳腺癌转归相关,多数情况下,cfDNA浓度较高是预后较差的独立因素,但也有报道称不能证实cfDNA水平与OS之间的相关性。Meta分析结果显示,乳腺癌患者的cfDNA与PFS(HR=2.02,95%CI:1.51~2.72,n=20)、OS(HR=1.75,95%CI:1.01~3.05,n=12)显著相关,且与cfDNA突变或cfDNA高水平的患者相比,无突变或cfDNA低水平的患者往往PFS更加获益,其中TP-53突变与PFS恶化显著相关,ESR1突变与OS不良显著相关,PIK3CA突变患者预后较差4。
通过对BOLERO-2研究中参与者的基线血浆样本cfDNA二次分析,评估cfDNA ESR1突变的发生率及其与预后的相关性,结果显示在541例可评价的患者中,156例患者(28.8%)存在ESR1 D538G和/或Y537S突变。无ESR1 D538G和Y537S突变患者的中位OS为32.1个月(95%CI:28.09~36.4个月),而突变患者的中位OS为20.73个月(95%CI:17.71~28.06个月)(图2A),其中仅D538G突变患者的中位OS为25.99个月(95%CI:19.19~32.36个月),仅Y537S突变患者的中位OS为19.98个月(95%CI:13.01~29.31个月),D538G、Y537S双突变患者的中位OS为15.15个月(95%CI:10.87~27.43个月) (图2B)。因此,研究者认为cfDNA ESR1突变与乳腺癌患者预后不良相关。9
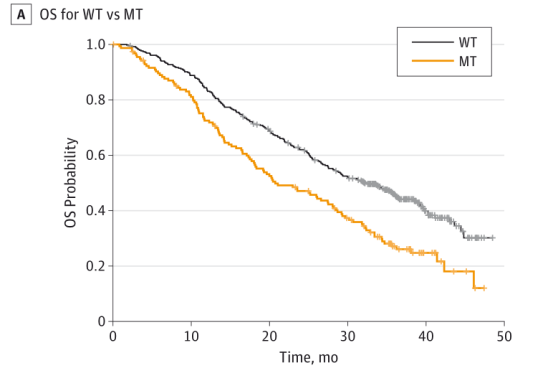

图2A:D538G和/或Y537S突变患者和ESR1(野生型[WT])无突变患者的OS结果图2B:WT、仅D538G突变、仅Y537S突变和D538G和Y537S双突变(双MT)患者的OS结果
今年ESMO公布两项关于cfDNA研究的最新结果,这两项临床研究均应用液体活检技术对乳腺癌患者的cfDNA进行分析,进一步肯定了cfDNA在临床中的应用价值,同时也发人深省。
277MO–SAR439859, an oral selective estrogen receptor (ER) degrader (SERD), in ER+/ HER2- metastatic breast cancer (mBC):Biomarker analyses from a phase Ⅰ/Ⅱ study
研究简介:SAR439859在WT和ESR1突变的mBC患者中具有抗肿瘤活性,在该项Ⅰ/Ⅱ期研究中(NCT03284957)中,经治的绝经后ER+/HER2-mBC患者接受SAR439859单药治疗(A组:剂量范围20–600 mg QD;B组:400 mg QD),分别在基线(BL,baseline)、治疗中(OT,on treatment)和治疗结束时(EOT,end of treatment,仅收集cfDNA)收集其血浆循环cfDNA和配对组织活检,并对BL及EOT时cfDNA中的 77个基因二代测序结果进行突变分析,通过ddPCR评估BL和OT时cfDNA中的ESR1突变情况,通过免疫组化评估雌激素受体(ER)、孕激素受体(PR)、Ki67和Bcl-2随时间的表达情况变化及通过RNA测序评估ER信号通路激活变化,同时对接受SAR439859≥150 mg/d的患者进行疗效评价。
主要结果:在63名患者BL时的cfDNA中,95%的患者携带≥1个突变,52%的患者携带≥1 个ESR1突变,92%的患者携带≥1个非ESR1突变,49%的患者同时携带ESR1和其他突变。常见的BL非ESR1突变有PIK3CA(44%)、EGFR(33%)、TP53(30%)和MET(25%)。在BL和EOT时最常见的ESR1突变是D538G、Y537S和Y537N。ESR1突变在治疗中(OT)有降低趋势,在基线时携带ESR1突变的14例患者中,有2例患者在治疗中 ESR1突变消失,变成野生型。在8对配对活检中(7对是高度增生的luminal B型肿瘤),ER、PR和Ki67下降(相对于BL的中位变化:-58%,-88%和-33%),而Bcl-2上升(24%)。ER激活评分在3/5对配对活检中下降(相对于BL的中位变化:-0.38)。通过ddPCR,SAR439859在40%(12/30)的WT ESR1和32%(9/28)的ESR1突变中显示了临床获益(CR+PR+SD≥24周),在5名PR患者中,4例在BL时携带WT ESR1,1例携带2个ESR1突变。
结论:大多数mBC患者可检测到常见的基因组变化,如ESR1和PIK3CA。SAR439859的临床获益与ESR1突变状态无关,且SAR439859可使经治患者的ER降解和通路抑制。
278MO - cfDNA analysis from phaseⅠ/Ⅱ study of lerociclib (G1T38), a continuously dosed oral CDK4/6 inhibitor, with fulvestrant in HR+/HER2- advanced breast cancer patients
研究简介:Lerociclib与氟维司群联合用药具有良好的安全性,其胃肠道不良事件和3/4级中性粒细胞减少症发生率低,且在HR+/HER2-ABC患者中具有抗肿瘤活性。前期研究中,经治的HR+/HER2-晚期乳腺癌(ABC)患者分别接受氟维司群(500mg)+lerociclib(200-650mg QD或100-250mg BID)治疗,在基线、C1D15(第1周期第15天)、治疗期间进行肿瘤评估的每个时间点和治疗结束时抽取外周血并进行cfDNA分析。
主要结果:目前,在基线时对58例患者进行评估,在评估的基因中,44例(75.9%)患者携带至少一种突变。PIK3CA突变有17例(29.3%),其中H1047R最常见(8/17,47.1%);ESR1突变有7例(12.1%),其中D583G最常见(4/7,57.1%);没有患者同时存在ESR1和PIK3CA突变。此外,3例(5.2%)、2例(3.4%)、1例(1.7%)患者在基线时携带CDK4/6耐药相关基因突变(分别为RB1,CCND1和CCNE1)。cfDNA的其他分析(C1D15和治疗结束)及cfDNA动态变化与临床反应的相关性研究正在进行中,并将在未来公布。
结论:基线时最常见的突变是PIK3CA和ESR1。cfDNA从基线到C1D15的变化及其与临床反应的相关性有助于阐明HR+ABC患者对lerociclib联合氟维司群治疗的反应和/或耐药性。
作为一项新兴技术,液体活检可全面筛查乳腺癌的不同分子结构,解决肿瘤内的异质性问题,使乳腺癌患者的全程管理得到改善。其中,cfDNA在血液中的浓度较高,其作为液体活检的标志物优于CTC及ctDNA,可以很好地预测晚期乳腺癌患者的疗效、无进展生存时间和总生存,在临床中具有潜在的应用价值, 但是它能否作为乳腺癌患者理想的生物靶标,目前仍存在以下问题:DNA分析技术的敏感性尚有不足,ctDNA/cfDNA分离技术有待优化,cfDNA定量检测的敏感度和特异度都需提高,最重要的是,需进一步明确cfDNA的可靠性,尤其是其起源和生物学意义,然后才能将其整合到临床中。未来,肿瘤生物标志物的发展前景在于开发高灵敏度、高选择性、高通量、小型高效检测平台,以满足生命科学和临床诊断学的切实需求。
医学博士,教授,博士研究生导师
大连医科大学附属二院肿瘤内科主任
辽宁省百千万人才百人层次
中国肿瘤临床学会理事
中国临床肿瘤学会(CSCO )乳腺癌专家委员会常委
中国抗癌协会乳腺癌专业委员会委员
辽宁省医学会肿瘤分会副主任委员
辽宁省抗癌协会乳腺癌专业委员会副主任委员
辽宁省抗癌协会肿瘤转移委员会候任主任委员
大连市医学会肿瘤分会候任主任委员
?
大连医科大学肿瘤学硕士研究生在读
曾获研究生一等奖学金





 京公网安备 11010502033352号
京公网安备 11010502033352号